
Anatomía Foliar y Caulinar
de Mutisia acuminata var. paucijuga y M. hamata (Asteraceae, Mutisioideae)
Leaf and Stem Anatomy of Mutisia
acuminata var. paucijuga
and M. hamata (Asteraceae, Mutisioideae)

 Carlos A. Gómez*,1,2
Carlos A. Gómez*,1,2  , M. Mercedes Alemán
1 , Diego López Spahr 1
, M. Mercedes Alemán
1 , Diego López Spahr 1  & Roberto H. Martínez1
& Roberto H. Martínez1
1 Laboratorio de Histología y Anatomía de
Plantas Facultad de Ciencias
Naturales, Universidad Nacional de Salta, Avenida Bolivia 5150, (A4408FVY) Salta, Argentina, mercialem@yahoo.com.ar
- https://orcid.org/0000-0002-5581- 7945; diegolopezspahr@gmail.com - https://orcid.org/0000-0001-6003-5588; martinezrobertohernan@gmail.com https://orcid.org/0000-0003-2786-3378
2 Laboratorio de Microscopía Electrónica de Barrido
(LASEM), Universidad Nacional
de Salta, Av. Bolivia
5150, (A4408FVY) Salta,
Argentina. autor corresponsal: carlosunsa@gmail.com - https://orcid.org/0000-0002-4870-8820
Resumen
Se presenta la anatomía foliar
y caulinar de Mutisia acuminata var. paucijuga y M. hamata, dos especies andinas,
con el objetivo de analizar
sus características anatómicas con potencial adaptativo
a su entorno. Se colectó
material vegetal en la provincia
de Salta (Argentina), el cual fue procesado mediante
técnicas convencionales para estudios con microscopía óptica
y microscopía electrónica de barrido. Ambas especies tienen similitud en sus caracteres anatómicos
foliares y caulinares, tales como tallo con anillo completo, hojas dorsiventrales con estomas
anomocíticos, tricomas glandulares.
M. hamata se distingue por sus caracteres xeromórficos, hojas con una cutícula
fuertemente estriada,
epidermis con abundantes tricomas y estomas parcialmente hundidos, además de los canales
secretores en la corteza
del tallo. Se presentan
las correspondientes fotomicrografías obtenidas con microscopio óptico y microscopio electrónico de barrido.
Palabras clave:
Canales secretores; Estrías
cuticulares; Histología; Xerófitas
Abstract
The leaf and stem anatomy of Mutisia acuminata
var. paucijuga and M. hamata, two andean species from South America,
is presented in order to analyze their anatomical features
with adaptive potential to their environment. Plant material was collected
in the province of Salta (Argentina) and processed using conventional techniques for light microscopy and scanning
electron microscopy studies. Both species
are similar in their leaf and cauline anatomical characteristics, such as, stem with complete
ring, dorsiventral leaves with anomocytic stomata, and glandular trichomes. M. hamata is
distinguished by its xeromorphic characters, leaves with strongly
striated cuticles, epidermis with abundant trichomes
and partially sunken stomata, and secretory
canals in the stem cortex. The corresponding photomicrographs obtained with optical microscopy and scanning
electron microscopy are presented.
Keywords: Secretory channels; Striated cuticle;
Histology; Xerophytes
Gómez, C. A., Alemán, M. M., López Spahr, D. & Martínez R. H. (2023) Anatomía Foliar y Caulinar
de Mutisia acuminata var. paucijuga y M. hamata (Asteraceae,
Mutisioideae). Revista Ciencias Naturales, 1(2), 99–106.
Recibido: 15/4/2023 Aceptado:
31/7/2023 Publicado: 15/8/2023 Editora
Asociada: Ana Zelarayan
INTRODUCCIÓN
Las características de las plantas están relacionadas al ambiente donde viven, así las plantas
xerófilas presentan adaptaciones anatómicas, fisiológicas y/o fenológicas que les
permite evitar o tolerar el estrés hídrico, entre otros factores (Fahn & Cutler,
1992; Dickison, 2000). Sin embargo, algunas
especies presentan rasgos anatómicos, mesomórficos y/o algunos xeromórficos, que les facilita colonizar diferentes ambientes,
incluidos aquellos con poca
disponibilidad de agua y nutrientes (Pérez-Cuadra & Cambi, 2014; Rivera et al.,
2017). Comprender y reconocer dichas adaptaciones resulta
útil para comprender la base genética
de la plasticidad que exhiben las plantas, y nos permite
entender la variación fenotípica en un mismo genotipo
(Gilroy & Trewavas, 2001;
Van Kleunen
& Fischer, 2005).
Por otra parte, las característicasanatómicas de las plantas posibilitan la interpretación de sus adaptaciones a su entorno (Metcalfe
& Chalk, 1979;
Kraus et al., 2010),
y resultan muy importantes para comprender los estudios relacionados con aspectos evolutivos, ecológicos y fisiológicos (Endress
& Gregory, 2000; Pérez-Cuadra & Cambi, 2014;
Rivera et al.,
2021; Martínez-Quezada et al., 2022).
La familia
Asteraceae, es una de las familias
más diversas de las Angiospermas. En Argentina
crecen unas 2600 especies (Zuloaga
et al., 2019).
La subfamilia Muti- sioideae
tiene su mayor diversidad en la región
andina, habitan ambientes
tanto hú- medos como secos,
tales como quebradas
y laderas de cerros, pastizales
de altura, suelos secos, pedregales
y salitrales; en general, son arbustos o pequeños árboles
que florecen en el
invierno y constituyen fuente de alimento para los
picaflores (Novara et al., 1995; Katinas
et al., 2008).
En la anatomía deAsteraceae se han descrito especializaciones ecológicas identificadas a través de características anatómicas, tales como, presencia de canales secretores, canales
laticíferos, haces médulares
y corticales,
tricomas glandulares, crecimiento secundario anómalo, entre otros, considerados de valor
taxonómico por su importante valor diagnóstico (Metcalfe
& Chalk, 1950; Fahn, 1979; Melo-de-Pinna & Menezes,
2002; Rivera et al., 2019,).
El objetivo de este trabajo
es presentar la anatomía foliar y caulinar
de dos especies andinas de Mutisia de la provincia de Salta, M. acuminata Ruiz& Pav. var. paucijuga (Griseb.) y M. hamata
Reiche (Asteraceae, subfam. Mutisioideae),
y relacionar sus características con el ambiente. Estas descripciones amplían
el conocimiento sobre la biología
de estas especies, y resultan
útiles para comprender ciertas adaptaciones anatómicas de las plantas a su entorno,
como así también
podrían contribuir a futuros estudios
filogenéticos de estas plantas.
MATERIALES Y MÉTODOS
En el presente trabajo
se estudiaron los órganos
vegetativos, tallo y hoja, de Mutisia acuminata
var. paucijuga (Fig.
1A) y M. hamata (Fig.
2A) (Asteraceae, subfam. Mutisioideae), ambas
especies son nativas del noroeste de Argentina. Mutisia acuminata var. paucijuga crece
entre 1700-3400 m s.m. y M.
hamata entre 2500-4500
m s.m., en Prepuna, Puna y Altoandino, regiones biogeográficas
caracterizadas por una marcada amplitud térmica (Cabrera,
1978).
Las muestras
para este estudio
provienen de la provincia
de Salta. Los ejemplares fueron identificados por el Ing. Diego López Spahr y depositados en el Herbario
MCNS: Mutisia acuminata var. paucijuga. Argentina. Salta. Dpto. Rosario
de Lerma, El Alisal, 1805 m.s.m., 13-11-2022, López Spahr s. n. (MCNS 13680). Mutisia hamata. Argentina. Salta. Las Cuevas, Dpto. Los Andes, 3500 m.s.m.,
13- 11-2022, López Spahr s.n. (MCNS 13681).
Para los estudios histológicos se tomaron cinco muestras de hojas y secciones
de tallos primarios en
estado vegetativo por ser éstos los órganos que exhiben mayor diversidad de caracteres morfoanatómicos (Dickinson, 2000).
En M. acuminata
var. paucijuga, de hojas pinnaticompuestas, se tomó de referencia a los folíolos
centrales. Para ambas especies se consideró el sexto entrenudo de ejes primarios.
El material
fue fijado y conservado en FAA (50 % de etanol, 10 % de formalina, 5 % de ácido acético).
Las muestras se deshidrataron usando una serie de alcohol
etílico, se infiltraron e incluyeron en parafina según Johansen (1940)
y luego fueron seccionadas (10-15 µm) por un micrótomo de deslizamiento Leica SM 2000R. Para la clasificación de los estomas
se siguió a Metcalfe
& Chalk (1979).
Las observaciones y fotografías se lograron
con un microscopio óptico Leica DM 2500.
Para el análisis con
microscopía electrónica de barrido (MEB),
se utilizaron cinco muestras
de cada órgano por cada especie
estudiada, las que fueron fijadas
y conservadas en glutaraldehido 2,5%, la deshidratación se realizó con una serie creciente de alcohol etílico,
posteriormente fueron secadas por punto crítico en un driying apparatus
DCP-1 critical point-Denton vacuum.
Las muestras fueron montadas
en tacos de aluminio, recubiertas con oro utilizando un equipo Denton vacuum-desk IV. Las observaciones fueron
realizadas con un microscopio Jeol JSM -6480
LV.
RESULTADOS
Anatomía caulinar de Mutisia acuminata
var. paucijuga
El eje caulinar,
en sección transversal, tiene forma circular (Figs. 1B-D), muestra
una epidermis (ep) uniestratificada con células isodiamétricas con cutícula delgada
y tricomas glandulares 1-2-celulares (tg); la corteza está constituida por colénquima angular organizado en dos capas de células
(c) seguido del tejido parenquimático (tp) formado por células isodiamétricas de gran tamaño con paredes delgadas; los 12 haces vasculares (hv) cerrados forman un anillo vascular (av) continuo que delimitan la médula
(m), cada haz vascular presenta
un casquete perifloemático de fibras (fi).
Anatomía foliar de Mutisia acuminata
var. paucijuga
La lámina es hipostomática, en sección
transversal (Figs. 1E-F)
tiene una epidermis uniestratificada, con epidermis
adaxial (ead) formada por células isodiamétricas y pirifomes de mayor tamaño, mientras la epidermis
abaxial (eab) tiene células
isodiamétricas regulares, en vista frontal
las células de paredes
suavemente onduladas
tienen estrías poco notables (Fig. 1G), y es-
tomas anomocíticos ubicados al mismo nivel de las células epidérmicas; el mesófilo es de
tipo dorsiventral, formado
por una capa de células parenquimáticas en empalizada (pe) y
4-6 capas de parénquima esponjoso
(pes) con haces vasculares colaterales pequeños (hv).
Anatomía caulinar de Mutisia
hamata
El eje caulinar,
en sección transversal (Figs.
2B-D) es circular, presenta
una epidermis uniestratificada con células isodiamétricas con cutícula delgada (ep), tricomas glandulares 2-4-celulares
(tg) y tricomas no glandulares, fi (t), largos;
la corteza presenta colénquima
angular (c) en dos capas, y pa- rénquima
(tp) formado por células
grandes de paredes delgadas con canales secretores (punta de fl los haces vasculares (hv) con casquete perifl con fi
(fi opuestas
al fl primario,
forman un anillo continuo (av) alrededor de la médula (m) constituida por células parenquimáticas de paredes delgadas.
Anatomía foliar de Mutisia
hamata
La lámina es anfiestomática, con trico- mas filiformes y glandulares; en corte transversal (Figs. 2E-F) muestra
una epi- dermis uniestratificada formada por células isodiamétricas en ambas epidermis,
cubiertas por con cutícula gruesa, en vista
frontal muestra células de paredes fuertemente onduladas (Fig. 2G) y notablemente estriadas, con estomas anomocíticos parcialmente hundidos; el me-
sófilo es de tipo dorsiventral constituido por dos capas de parénquima en empalizada (pe) y
dos capas de parénquima esponjoso
(pes) con grandes espacios intercelulares, y nervadura
central con lado convexo pronunciado hacia el lado abaxial, con haz vascular central
(hv).
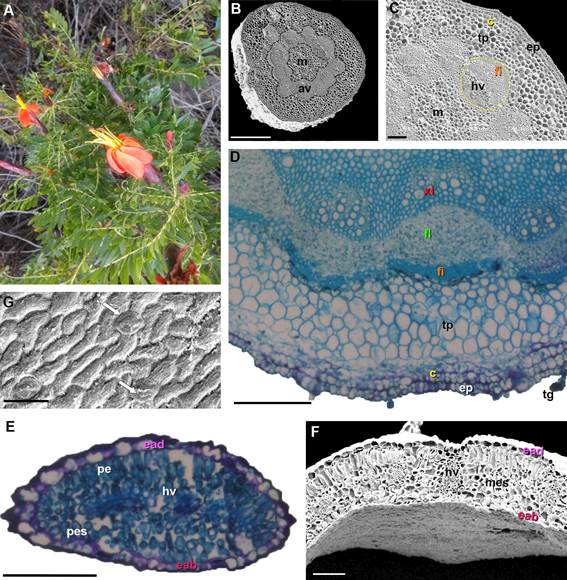
Figura 1. Mutisia acuminata var. paucijuga. A. Vista general de la planta. Fotomicrografía de cortes transversales caulinares
y foliares (MEB, MO). B. Corte transversal del tallo mostrando anillo vascular
(av) y médula (m). C-D. Detalle
de sección parcial del tallo, mostrando colénquima (c), tejido
parenquimático (tp), haz vascular (hv) con xilema
(x) y floema (fl), fibras
(fi), médula (m) y tricomas glandulares (tg). E-F. Corte transversal de lámina, epidermis abaxial
(eab), epidermis adaxial
(ead), parénquima empalizado (pe), parénquima esponjoso (pes), haz vascular (hv). G. epidermis abaxial con estomas
(flechas). Barras: B: 500 µm, C-D-E-F: 100 µm, G: 50 µm,
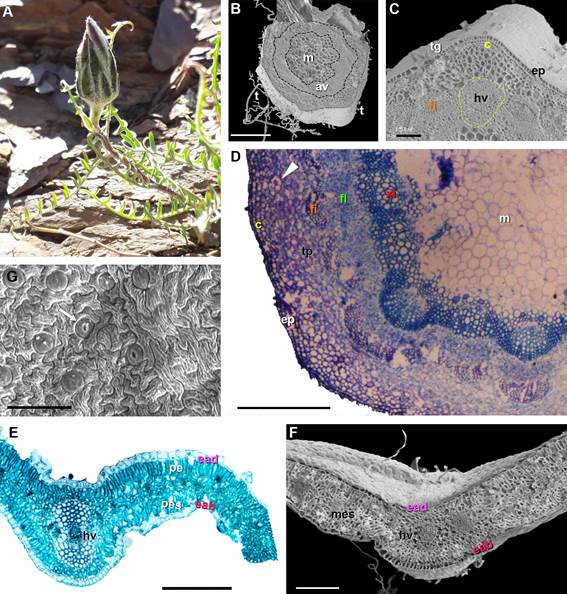
Figura 2. Mutisia hamata. A. Vista
general de la planta.
Fotomicrografía de cortes
transversales caulinares y foliares (MEB, MO). B. Corte transversal del tallo mostrando anillo vascular
(av) y médula (m). C-D. Detalle
de sección parcial del tallo, mostrando
colénquima (c), canal secretor (punta
de flechas), tejido
parenquimático (tp), haz vascular (hv) con xilema
(x) y floema (fl), fibras (fi), médula (m), tricomas largos (t) y tricomas glandulares (tg).
G. epidermis abaxial
con estomas (flechas). E-F. Corte transversal de lámina, epidermis abaxial
(eab), epidermis adaxial
(ead), parénquima empalizado (pe), parénquima esponjoso (pes), haz vascular
(hv). Barras: C-D-E-G:
100 µm; B-F: 200 µm.
Ambas especies se diferencian en el tallo, por
el tipo de tricomas, la presencia de canales de secreción y tipo de haces vasculares,
y en las hojas, por la forma de las células epidérmicas, depósito de cutina, posición
de los estomas e presencia de tricomas (Tabla 1).
|
Características anatómicas
|
Mutisia acuminata
var. paucijuga
|
Mutisia hamata
|
|
T A L L
O
|
Epidermis: tricomas
|
glandulares 1-2-celulares.
cortos
|
glandulares cortos 2-4-celulares, cortos, y no glandulares filifor- mes, largos
|
|
Corteza
|
sin canales de secreción
|
con canales
de secreción
|
|
Haces vasculares
|
cerrados
|
abiertos
|
|
H O J A
|
Tricomas
|
glabra
|
tricomas filiformes y glandulares
|
|
Posición de los esto- mas
|
hipostomática
|
anfiestomática, con estomas
par- cialmente hundidos
|
|
Células epidermicas:
vista frontal
|
paredes suavemente ondula- das con estrías
|
paredes fuertemente onduladas con estrías notables
|
Tabla 1. Diferencias anatómicas en la morfología caulinar y foliar entre Mutisia acuminata var. paucijuga y Mutisia hamata.
DISCUSIÓN Y CONCLUSIÓN
La anatomía
de Asteraceae no es uniforme
entre sus especies (Metcalfe
& Chalk, 1950; Ciccarelli et al., 2007; Da Silva et al.,
2014; Rivera et al., 2019). En este estudio, se encontró
que Mutisia hamata
y M. acuminata var. paucijuga tienen caracteres anatómicos que contribuyen a la identificación de las especies, como así también
comparten otros caracteres anatómicos.
En la anatomía caulinar
se observa que, ambas
especies tienen epidermis con tricomas glandulares y corteza con colénquima angular, aunque
se diferencian por la presencia de canales secretores en el parénquima cortical de M. hamata. Estos tricomas glandulares y canales secretores fueron descritos para otras especies
de la familia Asteraceae (Metcalfe & Chalk,
1979; Riveira et al., 2019).
Las hojas de M.
acuminata var. paucijuga son hipoestomáticas mientras que las de M. hamata
son anfiestomáticas, este tipo de hoja
también constituyen un carácter
frecuente en Asteraceae (Metcalfe & Chalk, 1950).
Ambas especies presentaron estomas del tipo anomocítico, tipo frecuente entre las especies de la familia Asteraceae y en otras familias de plantas vasculares (Metcalfe & Chalk, 1979;
Adedeji & Jewoola,
2008).
La epidermis de M. hamata
a diferencia de M. acuminata var. paucijuga, por sus células con paredes marcadamente sinuosas con cutícula gruesa con estrías notables, tricomas largos
y cortos, y estomas parcialmente hundidos, caracteres xeromóficos que facilitan su distribución hasta los 4500 m s.m. También se observó
cutícula estriada en Chaptalia integerrima (Vell.) Burkart
(Mutisieae) y otras Asteraceae, Calea
uniflora Less. (Neurolaeneae) y Noticastrum acuminatum (DC.) Cuatrec.
(Astereae) (Liesenfelda et al.,
2019). Adedeji & Jewoola (2008)
sugieren que la morfología de las estrías
puede considerarse como un carácter diagnóstico para identificar las especies.
Ambas especies se encuentran en un hábitat con baja disponibilidad de agua
y suelos pobres,
por lo que se esperaba que la anatomía
de las dos especies estudiadas, mostrara características típicas de plantas xerófilas
(Esau, 1976; Fahn & Cutler,
1992; Dickison, 2000; Cutler et al.,
2007), sin embargo,
el transcorte de la lámina,
muestra diferencias entre las células
epidérmicas, espesor de la cutícula y estrías.
Rivera et al. (2019)
sugieren que la presencia
de características mixtas, mesófitas
y xerófitas, ha sido una estrategia esencial
en Asteraceae para colonizar varios ambientes, incluidos
aquellos con poca disponibilidad de agua y nutrientes. Por otro lado, Fahn & Cutler (1992)
plantearon que las especies
xerófitas han evolucionado a partir
de la adaptación de plantas mesófitas
a suelos con baja
disponibilidad de nutrientes o a la falta de disponibilidad de agua y suelos
pobres.
En este estudio, se describe
por primera vez la anatomía de eje caulinar y foliar de M. acuminata var. paucijuga y M. hamata. Si bien ambas
especies cohabitan
a cierta altitud,
se evidencia que la anatomía de M. hamata le
permite a esta especie superar las condiciones ambientales en zonas andinas
de gran altitud.
AGRADECIMIENTOS
Los autores
agradecen a los revisores por sus valiosos
aportes y sugerencias, los cuales mejoraron significativamente la publicación.
También extendemos nuestro agradecimiento a Alejandro
Diaz por la colaboración en el procesamiento del material y a Ariana Gómez por su participación en los viajes de campaña.
Parte del trabajo fue financiada con el proyecto CIUNSa A N°2466, dirigido
por M. M. A.
REFERENCIAS
Adedeji, O., & Jewoola, O. A. (2008). Importance of leaf epidermal characters in the Asteraceae family. Notulae Botanicae Horti Agrobotanici Cluj-Napoca, 36, 7. htps://doi.org/10.15835/ nbha362243
Cabrera, A. L. (1978). Flora de la Provincia
de Jujuy, República Argentina. Parte X: Compositae. Colección Científica del Instituto
Nacional de Tecnología Agropecuaria, INTA. Buenos
Aires.
Ciccarelli, D., Garbari,
F., & Pagni,
A. M. (2007).
Glandular hairs of the ovary: a helpful character
for Asteroideae (Asteraceae) taxo- nomy?. Annales Botanici Fennici, 44, 1-7.
Cutler, D. F., & Botha, C. E. J. (2007). Plant anatomy.
Blackwell Publishing, Massachusetts.
 Da Silva, E. M. S., Hayashi, A. H., & Appezzato- da-Gloria, B. (2014).
Anatomy of vegetative organs
in Aldama tenuifolia and A. kunthiana (Asteraceae: Heliantheae). Brazilian Journal of Botany, 37, 505-517.
https://link.springer. com/article/10.1007/s40415-014-0101-2
Da Silva, E. M. S., Hayashi, A. H., & Appezzato- da-Gloria, B. (2014).
Anatomy of vegetative organs
in Aldama tenuifolia and A. kunthiana (Asteraceae: Heliantheae). Brazilian Journal of Botany, 37, 505-517.
https://link.springer. com/article/10.1007/s40415-014-0101-2
Dickison, W.
C. (2000). Integrative Plant Anatomy.
Academic Press. San Diego, Estados Unidos.
Esau, K. (1976). Plant
Anatomy. John Willey &
Sons Inc., New York.
Endress, P. K., Baas, P., & Gregory,
M. (2000). Systematic plant morphology and anatomy: 50 years of progress. Taxon, 49(3), 401-434. https://doi.org/10.2307/1224342
Fahn, A. (1979). Secretory Tissues in Plants. , Academic Press.
Fahn, A., & Cutler, D. F. (1992). Xerophytes.
Gebrüder Borntraeger.
Gilroy, S., & Trewavas, A. (2001). Signal processing and transduction
in plant cells: the end of the beginning. Nature Reviews Molecular Cell Biology, 2, 307-314.
https:// www.nature.com/articles/35067109#Abs1
Johansen, D. A. (1940). Plant microtechnique. Mc
Graw-Hill. Nueva York, Estados Unidos.
Katinas, L.,
Pruski, J., Sancho, G., &
Tellería,
M.C. (2008). The
subfamily Mutisioideae (Asteraceae). Botanical Review, 74, 469-716. https://link.springer.com/article/10.1007/ s12229-008-9016-6
Kraus, T. A., Basconsuelo, S., Grosso, M. A., & Malpassi, R. N. (2010).
Anatomía comparativa de raíces
em papilionoideas leguminosas. Un valor sistemático. Simposio de morfo- anatomia e ecofisiologia. V Conferencia
Internacional de Leguminosas, Buenos Aires.
Liesenfeld, V., Gentz,
P., De Freitas, E. M., & Martins, S. (2019). Leaf morphology and anatomy of Asteraceae of the Pampas biome (sand-fields). Flora, 258, 151418. https://doi. org/10.1016/j.flora.2019.151418
Martínez-Quezada, D. M., Rivera, P., Rojas-Leal, A., Villaseñor, J. L., & Terrazas, T. (2022). Leaf secretory
structures in Asteraceae: a synthesis
of their diversity and evolution. The Botanical Review, 89, 59-90. https:// doi. org/10.1007/s12229-022-09276-4
Metcalfe, C. R., & Chalk, L. (1950). Anatomy
of the Dicotyledons; leaves,
stem and wood in relation to taxonomy with notes on economic uses. Clarendon Press. Oxford,
Inglaterra.
Metcalfe, C. R., & Chalk, L. (1979). Anatomy of the Dicotyledons, Volume I. Clarendon Press. Oxford, Inglaterra.
Melo-de-Pinna, G. F., &
Menezes, N. L. (2002). Vegetative organ anatomy
of Ianthopappus corymbosus Roque & Hind (Asteraceae-Mutisieae). Brazilian Journal
of Botany, 25, 505-514. https://doi.org/10.1590/S0100-
84042002012000014
Novara, L., Katinas,
L., & Urtubey, E. (1995). Asteraceae, Tribu Mutisieae. Aportes Botá- nicos de Salta,
Serie Flora, 3, 1-86.
Pérez Cuadra, V., &
Cambi, V. N.(2014).
Ocurrencia de caracteres anatómicos funcionales foliares
y caulinares en 35 especies
Xero- halófilas. Boletín
de la Sociedad Argentina de Botánica, 49, 347-359.
https://doi. org/10.31055/1851.2372.v49.n3.9465
Rivera, P., Villaseñor, J. L., Terrazas,
T., & Panero,
J. L. (2021). The importance
of the Mexican taxa of Asteraceae in the family
phylogeny. Journal of Systematics and Evolution, 59, 935-952. https://doi.org/10.1111/jse.12681
Rivera, P., Terrazas,
T., Rojas-Leal, A., & Villaseñor, J. L. (2019). Leaf architecture and anatomy of Asteraceae species in a xerophytic scrub in Mexico City, Mexico.
Acta Botánica Mexicana, 126, e1515. https:// doi.org/10.21829/abm126.2019.1515
Rivera, P., Villaseñor, J. L., & Terrazas, T. (2017).
Meso or xero morphic? Foliar characters of Asteraceae in a xeric scrub of Mexico. Botanical Studies, 58, 12. https://doi. org/10.1186/s40529-017-0166-x
Van Kleunen, M., & Fischer, M. (2005).
Constraints on the evolution
of adaptive phenotypic plasticity in plants. New phytologist, 166, 49-60. https://doi.org/10.1111/j.1469-8137.
2004.01296.x
Zuloaga, F. O., Belgrano, M. J., & Zanotti, C.
A. (2019). An
update of the Catalogue of the Vascular
Plants of the Southern
Cone. Darwiniana, 7(2), 208-278. http://dx.doi. org/10.14522/darwiniana.2019.72.861
Carlos A. Gómez*,1,2
, M. Mercedes Alemán
1 , Diego López Spahr 1
& Roberto H. Martínez1